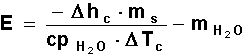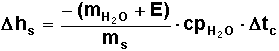Guía de Trabajos Prácticos
Cátedra: Termodinámica
Trabajo
Práctico: Calor de Combustión
Objetivo
Determinar el poder
calorífico de una sustancia.
Fundamentos
Teóricos
Es la cantidad de
calor liberada cuando se quema en forma completa un mol gramo de una dada
sustancia , en condiciones de temperatura y presión constantes, dando como
productos de reacción CO2 y H2O. En caso de no conocerse
el peso molecular de la sustancia (como sucede con la muestra de aserrín en
este trabajo práctico) se hablará de poder calorífico.
Poder calorífico superior
Es el calor liberado
cuando se quema en forma completa la unidad de masa (por ej., 1 gr) o de
volumen de una dada sustancia a P y T ctes, cuando en el estado final el agua
se halla en fase líquida.
Poder calorífico inferior
Es el calor liberado,
cuando se quema en forma completa la unidad de masa o de volumen de una dada
sustancia, a P y T constantes, cuando el agua en el estado final se encuentra
en fase gas.
Es decir que el Poder
Calorífico inferior es menor que el Poder Calorífico Superior debido a que
parte del calor generado por el quemado de la sustancia se gasta en vaporizar
el H2O formado.
La determinación del
calor de combustión (o el poder calorífico) se realiza en la bomba
calorimétrica, método que consiste en quemar una sustancia en una atmósfera de
oxígeno a presión. (Se emplea la bomba de Berthelot modificada por Mohler y
Broker).
Se observará que a
diferencia de otros calorímetros la bomba calorimétrica trabaja a volumen
constante.
Por otro lado, debido
a las condiciones de temperatura y presión a las que opera la bomba, el agua
producida en la combustión se hallará al final del proceso al estado líquido de
donde se infiere que la bomba calorimétrica permite determinar el poder
calorífico superior de una sustancia.
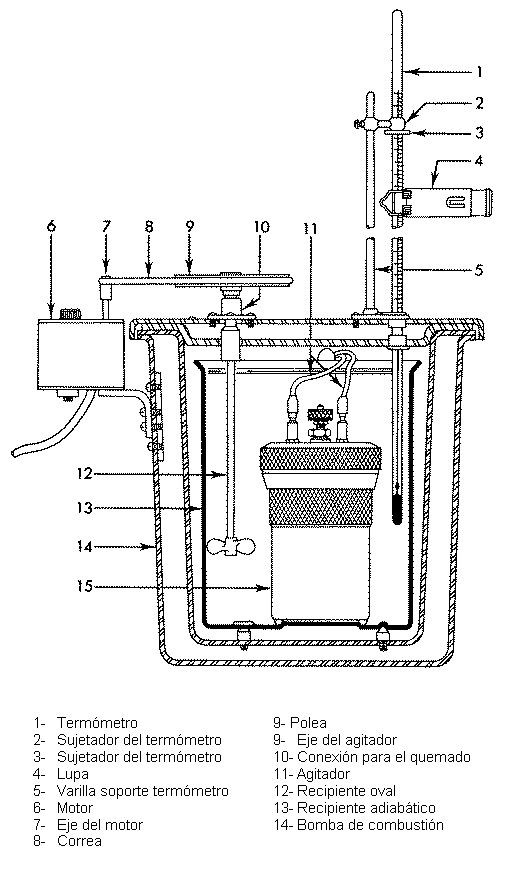
Descripción del equipo
La Bomba Calorimétrica
Está constituida por
un recipiente de acero inoxidable, cuyo
interior se encuentra esmaltado. La tapa se mantiene en su posición mediante un
fuerte cierre de rosa; el recipiente se hace hermético al gas mediante
arandelas. La tapa está provista de 2 canales por los cuales entra y sale el
oxígeno, ambos están cerrados por medio de las válvulas V1 y V2
.
La continuación del
canal C2 está formada por un tubo también de acero inoxidable R, del
cual se suspende el crisol en el que se caerá la sustancia que no fuera
quemada. En el caso particular de este trabajo práctico no se recogerá el
residuo.
C2 V2 V1
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
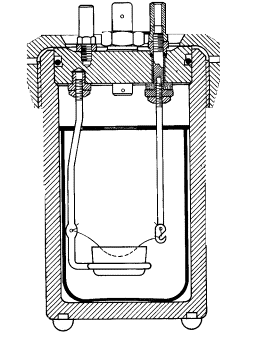
La ignición de la sustancia se
efectúa por medio de un trozo de alambre de Fe o platino, el cual se calienta
momentáneamente al rojo por el pasaje de una corriente eléctrica.
El Calorímetro
El calor de combustión
se mide por la elevación de temperatura producida en un dado peso de agua,
operando en el interior del calorímetro.
El calorímetro
consiste en un recipiente de paredes dobles, entre las cuales existe una cámara
de vacío que actúa como aislante.
Dentro hay otro
recipiente, de acero inoxidable, que contiene el agua en la que se sumerge la
bomba.
El agua del
calorímetro se agita regularmente por medio de un dispositivo mecánico, que
asegura una buena homogeneización del medio.
La elevación de la
temperatura se determina por medio de un termómetro con apreciación de 1/100 de
grado.
El equivalente en agua
del calorímetro debe determinarse quemando un peso conocido de una sustancia de
calor de combustión bien establecido (generalmente se emplea ácido benzoico).
Dicha sustancia
suspendida en el alambre de Fe (cuyo peso debe conocerse, de manera de conocer
exactamente la cantidad de sustancia utilizada), se quema de acuerdo a la
técnica. De este modo podremos conocer la cantidad de calor intercambiado, que
en conjunto con el salto de temperatura corregido, y la masa de agua en el
calorímetro, nos permitirá determinar el equivalente del calorímetro.