Guía de
Trabajos Prácticos
Cátedra: Termodinámica
Trabajo Práctico: Soluciones Líquidas Reales - Propiedades
Molares Parciales
Carrera: Ingeniería Química
Introducción
Se define
como mezcla perfecta
a aquella para la cual se cumple
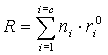 (1)
(1)
donde
R es una propiedad extensiva de la
mezcla (volumen, entalpía de la mezcla, etc.), rºi es la propiedad molar del componente i puro a la misma T y P de la mezcla y c es el número de componentes presentes
en la mezcla.
![]()
Con el objeto de representar el comportamiento real de las mezclas a través
de una expresión que conserve la forma de la ecuación (1), se introduce el
concepto de propiedad molar parcial (![]() )
)
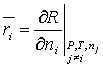 cumpliéndose que
cumpliéndose que ![]() (2)
(2)
Se puede demostrar, aplicando el teorema de Euler, que la propiedad molar
parcial es una propiedad intensiva, como así también la validez de la ecuación
(2), cuando la propiedad R se expresa
en función de P, T y c variables extensivas.
![]()
Parte I:
Volumen Molar Parcial
Objetivo
Observación de la diferencia de comportamiento entre una mezcla real y una
mezcla perfecta.
Fundamento
Teórico
Se circunscribirá el análisis al caso de mezclas binarias.
Si al mezclar dos sustancias puras, el volumen ocupado resulta ser: VP
= V1 + V2, se dice que para esa solución se cumple la
aditividad de volúmenes, ya que el volumen final es la suma de los volúmenes
iniciales antes del mezclado.
El volumen ocupado por un sustancia pura está dado por ![]() , por lo tanto:
, por lo tanto:
![]()
![]()
que es la
misma expresión que resultaría de aplicar la ecuación (1).
 Es decir, que los enunciados de aditividad de volúmenes y mezcla perfecta
son equivalentes.
Es decir, que los enunciados de aditividad de volúmenes y mezcla perfecta
son equivalentes.
Para el caso de mezclas reales, según la ecuación (2):
![]()
Al efecto de comparar el comportamiento de una mezcla real con el de una
mezcla perfecta, se tomará como ejemplo el sistema binario agua-etanol en fase
líquida.
En la figura (I) se ha graficado vm
vs. wetanol para dicho sistema (extraído de
"Thermodynamics"; Abbott, N., y Van Ness, H., pág. 239-239), y donde:
![]()
![]()
En dicha figura se ha ejemplificado el cálculo de los volúmenes másicos
parciales de etanol y agua en una solución cuya fracción en peso es wetanol
= 0,5. Así, para cada wetanol pueden obtenerse los valores
numéricos de los volúmenes másicos parciales y graficarse estos vs. wetanol.
La curva que resulta se representa en la figura (II).
En las figuras (I) y (II), la línea de trazos representa el comportamiento perfecto.


Técnica
Operatoria
§
En un matraz de 50 ml, agregar mediante
bolpipeta, 25 ml de etanol 96%w.
§
Agregar 25 ml de agua desde una bureta.
§
Observar que no se ha logrado enrasar
el aforo del matraz.
§
Enrasar con agua midiendo la cantidad
agregada.
Cálculos
a)
Con los datos de la experiencia, hallar
el volumen específico de la mezcla: ![]()
b)
Verificar ese valor con el valor de vm obtenido, para igual wetanol,
de la figura (I) y de la figura (II)
c)
Comparar los valores de vm obtenidos en los puntos a
y b, con el obtenido por la aplicación de la ecuación de mezcla perfecta.
Parte II:
Entalpía Molar Parcial
Objetivo
Construir un diagrama entalpía de mezcla vs. concentración para el sistema
agua-ácido acético. Calcular los calores integrales de disolución, de dilución
y calores diferenciales para diferentes concentraciones para el sistema
agua-ácido acético.
Fundamento Teórico
Si al mezclado (modificación) de dos o más sustancias a presión y
temperatura constantes, se le aplica el primer principio de la termodinámica,
resulta,
![]()
Como los procesos de mezclado se conducen normalmente a presión constante,
al calor evolucionado en los mismos se lo identifica con el cambio entálpico.
Se define la entalpía de mezclado como el cambio de entalpía producido
cuando dos o más sustancias puras se mezclan a temperatura y presión constantes
para formar una solución.
![]()
![]()
![]()
![]()
Lógicamente, los valores que se hallan tabulados son intensivos (expresados
por mol de soluto o por mol de mezcla) y están dados en función de la
concentración. En la bibliografía se pueden encontrar los siguientes valores:
Entalpía de Mezcla
![]()
Calor Integral de Disolución de 2
![]()
Puede hallarse también el calor
integral de dilución que se define como el cambio entálpico por mol de
soluto que se produce cuando a una solución se le modifica su composición a T y
P constantes por agregado de uno de los componentes puros.
Normalmente, dichos valores se determinan experimentalmente a través de la
medición de las cantidades de calor puestas en juego durante el proceso de
mezclado.
La técnica se denomina calorimetría de soluciones.
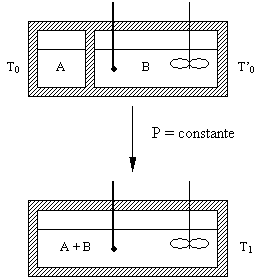 Si partimos de ambos compuestos A y B puros, la expresión del primer
principio aplicada al sistema será:
Si partimos de ambos compuestos A y B puros, la expresión del primer
principio aplicada al sistema será:
![]()
Suposiciones:
P
= constante
Q
= 0 (adiabaticidad)
W
despreciable
![]()
![]()
siendo DH dependiente de la temperatura, la presión y
los números
de moles de cada componente e independiente
del camino
seguido en el proceso de mezclado (funciones de
estado).
Por lo tanto, sólo a los fines del cálculo de la diferencia
entre ambas entalpías, es posible elegir un
"camino" arbitrario,
hipotético. Por ejemplo puede suponerse que
el proceso se
desarrolló
del siguiente modo:
-
Calentamiento de A y B (puros),
agitador, termómetro y calorímetro hasta T1
-
Mezclado de A y B a T1 y P
constantes
Si B es agua y se encuentra, previo al agregado, en equilibrio térmico con
agitador termómetro y paredes, entonces la variación de entalpía será,
suponiendo valores medios de cp entre T1 y ![]() :
:
![]()
Por definición de equivalente en agua del calorímetro:
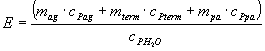
![]() (3)
(3)
Si luego se agrega una cantidad ![]() de la sustancia A, entonces variará la concentración de
la solución y el consiguiente efecto térmico hará variar la temperatura de la
solución. Esquemáticamente:
de la sustancia A, entonces variará la concentración de
la solución y el consiguiente efecto térmico hará variar la temperatura de la
solución. Esquemáticamente:

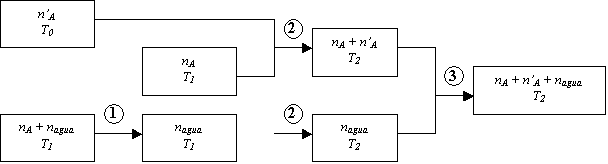
Análogamente a la primera etapa de disolución, se puede
elegir un camino hipotético, por ejemplo el indicado en el esquema:
las etapas
consideradas fueron:
1-
"separación" de H2O
y A a P, T1 (-![]() )
)
2-
"calentamiento" de todas las
sustancias (más el equivalente) hasta T2
3-
mezclado a P y T2 (![]() )
)
Entonces:
![]() (4)
(4)
despejando de
(3):
![]()
y reeplazando
en (4) se tiene
![]() (5)
(5)
con lo que
podemos calcular la entalpía de mezcla a T2
y P, midiendo las temperaturas y los moles agregados.
Haciendo un análisis análogo para cada etapa es posible calcular la
entalpía de mezcla para cada uno de ellas.
Es importante tener en cuenta que ![]() y
y ![]() son las entalpías de
mezcla a distintas concentraciones y a distintas temperaturas. Sin embargo,
debido a que en el presente práctico se trabaja con saltos pequeños de
temperatura, puede considerarse sin mucho error, que los calores integrales
obtenidos corresponden a una misma temperatura (T1).
son las entalpías de
mezcla a distintas concentraciones y a distintas temperaturas. Sin embargo,
debido a que en el presente práctico se trabaja con saltos pequeños de
temperatura, puede considerarse sin mucho error, que los calores integrales
obtenidos corresponden a una misma temperatura (T1).
Descripción del aparato
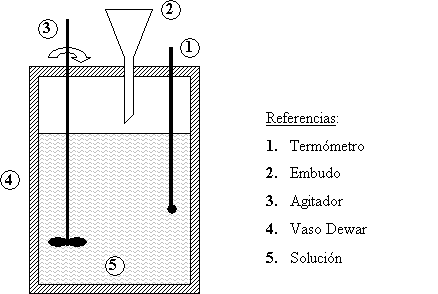
Consiste en un vaso Dewar que actúa como calorímetro. En
la tapa presenta tres orificios que permiten la introducción del eje del
agitador, el termómetro y el embudo por donde se introducen las muestras.
Técnica Operatoria
Determinación
del equivalente del calorímetro a partir de una sal de entalpía de mezcla
conocida
El equivalente se determina mediante una sal cuya entalpía de mezcla se
conoce perfectamente el calor de disolución en el agua. Se utiliza KNO3.
La sal deberá molerse previamente al secado, luego se lleva a estufa y una vez
seca se coloca en el desecador. Previo a la introducción de la sal se debe
agitar y medir la temperatura por lo menos durante tres minutos. Se pesa
cuidadosamente el KNO3 y se introduce por medio de un embudo en el termo,
verificando que no quede sal en las paredes. El equivalente obtenido a partir
de la ec. (3)
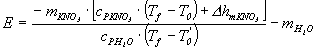 (6)
(6)
Durante la experiencia debe verificarse la correcta agitación de la
solución. Se deberá graficar temperatura - tiempo para determinar ![]() .
.
Determinación
de los calores de mezcla
El sistema en estudio será agua -
ácido acético. Se coloca el volumen de agua adecuado en el termo, se
estabiliza y lee la temperatura, agitándola durante tres minutos y por medio de
una bureta automática se introduce ácido acético en cantidades previamente
calculadas, de manera que correspondan a las concentraciones estipuladas.
El salto de temperatura que se produce se lee mediante un termómetro con
divisiones de 0,2 ºC; una vez agregado el volumen de ácido, se homogeneiza
mediante agitación y se toman las lecturas de la temperatura para confeccionar
la tabla temperatura - tiempo (también se lee la temperatura del ácido puro).
Se procede a agregar el segundo volumen, se deja estabilizar la temperatura, se
la mide para ir completando la tabla y se continúa con el agregado de los otros
volúmenes, procediendo de igual manera en cada caso.
En el agregado del primer volumen de ácido se parte de los compuestos puros
y se llega a una solución de concentración dada. Durante este lapso la presión
es aproximadamente constante (presión atmosférica).
El cambio entálpico producido puede hallarse aplicando la ecuación (3).
Si se divide este valor por el número de moles totales, se obtiene ![]() para una
concentración determinada. Si se lo divide por el número de moles de ácido
acético o de agua se obtendrá el calor integral de disolución.
para una
concentración determinada. Si se lo divide por el número de moles de ácido
acético o de agua se obtendrá el calor integral de disolución.
En el agregado de los siguientes volúmenes de ácido se parte de una
solución de concentración dada y compuesto puro ácido acético, dando una
solución de concentración conocida.
El cálculo de los calores integrales de disolución, deberá hacerse ahora
teniendo en cuenta la ecuación (5). Análogamente para las posteriores etapas de
dilución.
Tanto para la determinación del equivalente como para cada agregado de
ácido acético se debe construir la tabla temperatura - tiempo.
Con la ecuación (6) se calcula el equivalente, con la (5) se calcula el ![]() para cada etapa.
Dividiendo
para cada etapa.
Dividiendo ![]() por el número total
de moles se calculará el
por el número total
de moles se calculará el ![]() que se graficará vs. xácido; y dividiendo
que se graficará vs. xácido; y dividiendo ![]() por nácido o por nagua se calcula
por nácido o por nagua se calcula ![]() .
.
Para realizar un mejor analisis de los resultados se construirán las
gráficas:
![]() vs. xácido
vs. xácido
![]() vs. nácido
vs. nácido
Se calcularán los calores diferenciales de disolución del agua y del ácido
para xácido = 0,05.
Se realizará el test de consistencia termodinámica, graficando:
![]() vs. r
vs. r
![]() vs. r
vs. r
donde: ![]()
Bibliografía
1.
Glasstone, S. Termodinámica Química
2.
Balshizer, R.; Samuels, M. y Eliasse,
J. Termodinámica Química para Ingenieros.
Prentice Hall, 375, 1974
3.
Apuntes de cátedra (FIQ - UNL)
Anexo
Datos a registrar
a. Determinación del Equivalente
![]() masa de agua utilizada ....................................................... _______ gr.
masa de agua utilizada ....................................................... _______ gr.
![]() masa de KNO3 utilizada ...................................................... _______ gr.
masa de KNO3 utilizada ...................................................... _______ gr.
![]() calor específico del KNO3 ................................................... _______
calor específico del KNO3 ................................................... _______ ![]()
![]() temperatura inicial del agua ................................................ _______ ºC
temperatura inicial del agua ................................................ _______ ºC
![]() temperatura inicial del KNO3 ............................................... _______ ºC
temperatura inicial del KNO3 ............................................... _______ ºC
![]() temperatura final del sistema .............................................. _______ ºC
temperatura final del sistema .............................................. _______ ºC
![]() entalpía de mezcla
del KNO3 .............................................. _______ ºC
entalpía de mezcla
del KNO3 .............................................. _______ ºC
b. Determinación de la entalpía de mezcla
![]() masa de agua utilizada........................................................ _______ gr.
masa de agua utilizada........................................................ _______ gr.
E equivalente del sistema........................................................ _______ gr.
![]() temperatura
inicial del agua................................................. _______ ºC
temperatura
inicial del agua................................................. _______ ºC
![]() temperatura inicial del ácido acético.................................... _______ ºC
temperatura inicial del ácido acético.................................... _______ ºC
![]() temperatura final del sistema en la etapa
i.......................... _______ ºC
temperatura final del sistema en la etapa
i.......................... _______ ºC
![]() masa de ácido acético colocado en la etapa i..................... _______ gr.
masa de ácido acético colocado en la etapa i..................... _______ gr.